金属离子(如铁和铜等)代谢稳态对维持细胞活力至关重——已有研究证明,铁死亡诱导剂(FINs)在癌症中具有巨大的潜力,特别是在铁死亡易损伤的癌症中。而铜死亡是另一种新兴的金属离子依赖的调节细胞死亡方式,它依赖于细胞内铜,细胞内过量的铜直接在三羧酸(TCA)循环中与脂酰化成分结合,导致脂酰化相关蛋白的聚集,从而破坏蛋白质稳态,最终触发一种独特的细胞死亡方式。因此,铜离子载体在癌症治疗中引起了极大的兴趣。
那么,铁死亡与铜死亡之间是否存在关系呢?
近日,相关研究人员在中科院一区J Exp Clin Cancer Res杂志发表了研究成果,探索了肝癌细胞中铁死亡与铜死亡之间潜在的相互作用——研究表明,铁死亡诱导剂能够引发并增强肝癌铜死亡;如果同时使用铁死亡诱导剂与铜死亡诱导剂,则可以引发更大的细胞死亡。

一、研究内容与思路
1、铁死亡诱导剂增强了铜诱导的肝癌细胞死亡
研究者使用了两种典型铁死亡诱导剂——索拉非尼和伊拉斯丁。
结果显示,铁死亡诱导剂(FIN)可以显著抑制细胞生长,使得细胞内脂质过氧化增加,也就是说两种肝癌细胞HCC和ICC细胞均出现了铁死亡。进一步发现,如果使用这两种FIN去处理携带铜离子的伊利司莫的肝癌细胞,则能引发更大程度的细胞死亡。
已有研究表明,四硫钼酸盐(TTM)能够与铜结合,但对铁死亡诱导剂没有影响。对此,作者采用另一种铜离子载体DDC与两种FIN一起引起了更大程度的细胞死亡,并在此之后加入TTM。结果显示,TTM可以逆转这一增强效果,即FIN加重细胞死亡离不开铜。
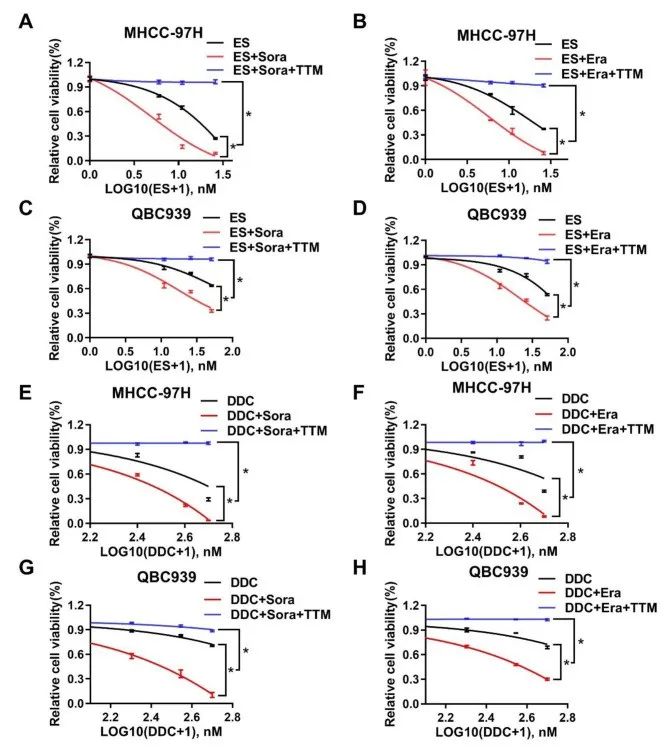
研究思路1:探讨铁死亡与铜死亡之间是否存在联系——研究者首先明确细胞会出现铁死亡,之后在存在铜离子的细胞中加入铁死亡诱导剂,发现细胞死亡效果比铁死亡效果更显著;而减少铜离子的存在会抑制这一增强效果。由此可见,铁死亡诱导剂增强了铜诱导的死亡。
2、铁死亡诱导剂促进肝癌细胞的铜死亡
接下来,作者探讨FIN增敏效应是否会导致铜死亡增强。铜死亡特征是脂酰化蛋白的聚集,如DLAT表达增加。对此,作者发现,携带铜离子的伊利司莫会导致DLAT聚集,而携带铜离子的伊利司莫联合FIN会显著增强肝癌细胞中DLAT的聚集,且这种增强效果与细胞凋亡无关。
进一步,作者发现,敲除铜死亡调节子LIAS或FDX1不仅可以逆转伊利司莫-铜诱导的DLAT聚集,还能逆转FIN促进伊利司莫-铜诱导的细胞死亡效果。综上所述,FIN促进了肝癌细胞的铜死亡。
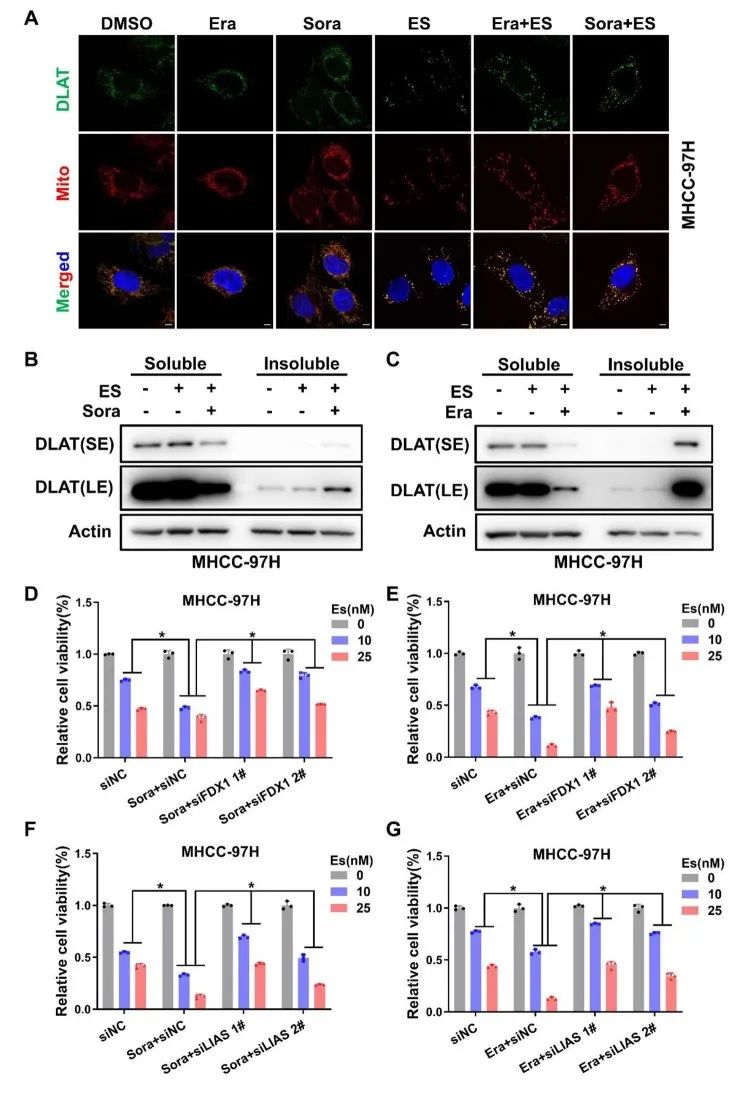
研究思路2:在明确“FIN可以进一步增强铜离子存在的细胞死亡”之后,推测铁死亡跟铜死亡可能存在联系,但具体存在什么联系呢?探索之后得出结论:铁死亡可以增强铜死亡,这一增强效果与细胞凋亡无关。
3、铁死亡诱导剂通过消耗细胞内GSH促进铜死亡
FIN通过抑制GSH合成来促进铁死亡,而GSH又被证明能与铜结合来抑制铜死亡,对此,作者探究GSH是否桥接了铁死亡和铜死亡之间的联系。
结果显示,携带铜离子的伊利司莫联合FIN的肝癌细胞内GSH含量减少,而外源性补偿GSH会减弱携带铜离子的伊利司莫联合FIN导致的细胞死亡程度,还会消除DLAT聚集物。
综上所述,铁死亡诱导剂通过消耗肝癌细胞内GSH促进铜死亡。
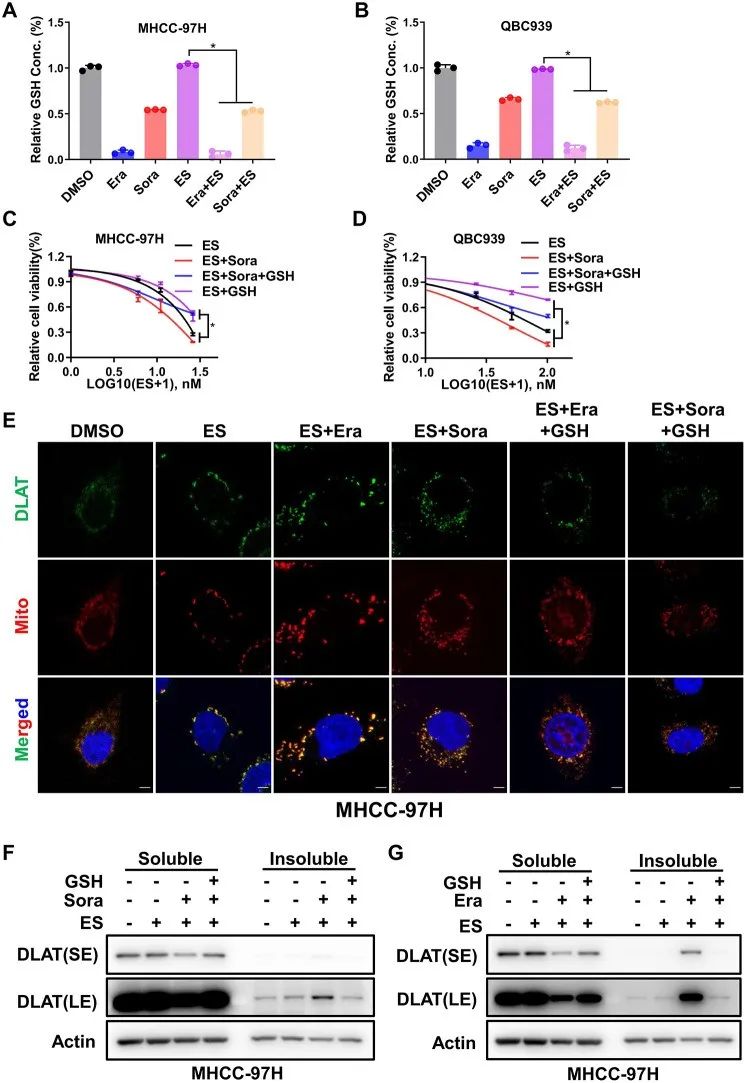
研究思路3:铁死亡诱导剂可以增强铜死亡,但究竟是如何发挥的作用的呢?作者文献检索发现,铜死亡与铁死亡都会受到GSH影响,从而将GSH作为研究对象。
4、铁死亡诱导剂通过抑制线粒体依赖性的FDX1蛋白降解来促进蛋白脂质化
LIAS和FDX1是负责蛋白脂质化的两个关键上游蛋白,作者进一步探讨了FINs是否能改变DLAT或DLST等蛋白的脂质化水平。实验发现,FIN治疗后,FDX1增加但LIAS没有增加,敲除FDX1可以挽救FIN诱导的lip-DLAT和lip-DLST的上调,表明FIN可以通过上调FDX1来增强蛋白的脂酰化作用。
但FIN并不能增加FDX1的mRNA水平,且抑制抑制蛋白酶体和溶酶体这两种主要的蛋白降解途径并不能提高FDX1的蛋白水平,即还存在其他作用途径来控制FDX1。FDX1位于线粒体中,于是研究者分析了几种线粒体蛋白酶对于FDX1的影响三种线粒体基质相关蛋白酶可能参与了FDX1的周转,但AFG3L2复合物似乎是主导的。同样地,AFG3L2基因敲低确实使肝癌细胞对铜诱导的细胞死亡敏感。
综上所述,FINs可以通过抑制线粒体基质相关蛋白酶介导的FDX1蛋白降解来上调蛋白脂化水平,将有助于铁死亡诱导增强铜死亡。
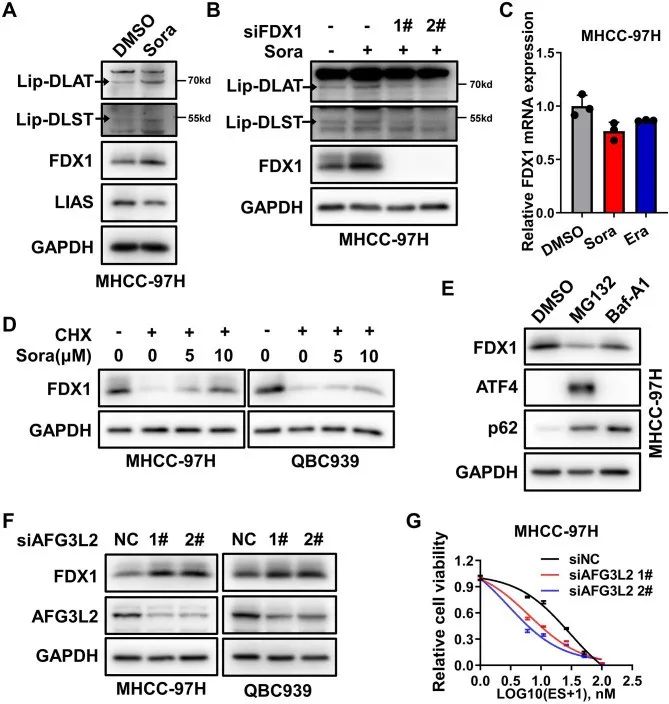
研究思路4:铜死亡导致脂酰化相关蛋白的聚集,于是作者检测了负责蛋白脂质化的两个关键上游蛋白LIAS和FDX1,并发现了FDX1的特殊性。进一步根据FDX1存在的位置,来开展作用分子机制的探讨。
5、铁死亡诱导剂促进了肝癌的体内铜死亡
进一步开展体内实验,发现与体外实验结果一致,裸鼠异种移植模型显示携带铜离子的伊利司莫联合FIN显著抑制了肝癌细胞的生长,DLAT聚集物更为明显。综上所述,FIN促进了肝癌的体内铜死亡。
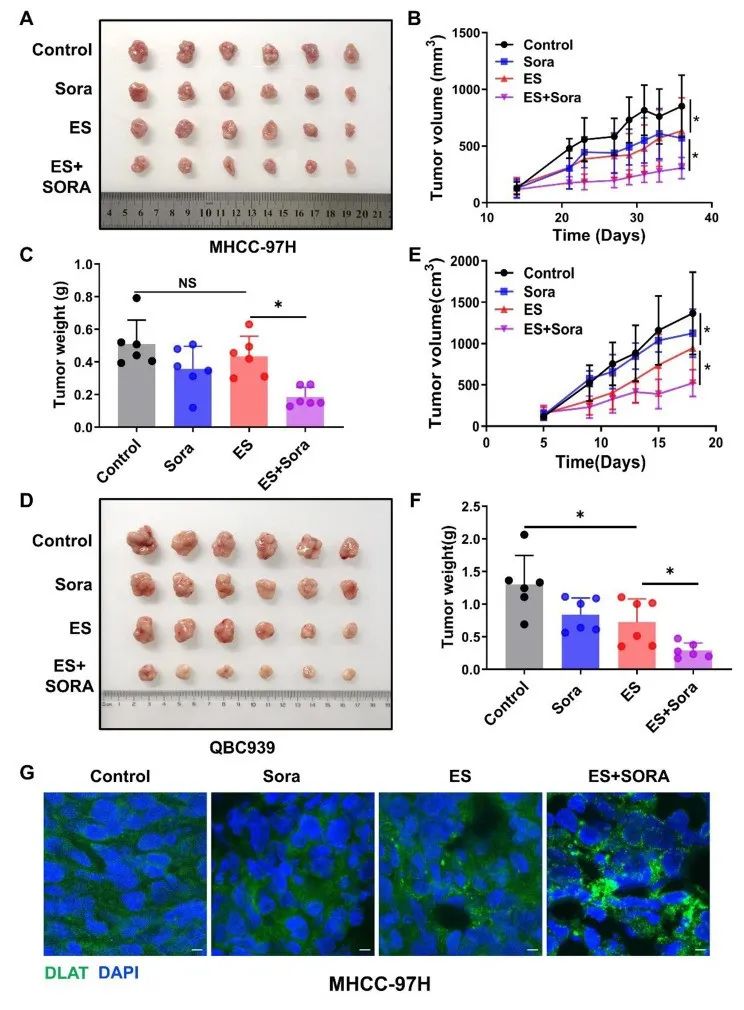
研究思路5:最后采用动物实验来进行验证,表明动物实验结果与细胞实验结果一致,肯定了研究可靠性。
二、小结
先前大多数研究都只是探讨铁死亡或铜死亡对于癌症细胞的影响,而作者将铁死亡与铜死亡联系起来,并推测既然都是金属离子,那么这两种死亡是不是存在着一些联系以及存在着什么联系。
基于此,研究者首先证明“铁死亡促进铜死亡,达到1+1>2的效果”;接着,间接探讨了作用分子机制;最后,开展动物实验,确定了研究结果。
这项研究表明:铁死亡诱导剂可以引发及增强肝癌铜死亡,铁死亡诱导剂与铜死亡诱导剂一起使用能够引发更大的细胞死亡。
参考文献:
[1] Wang W, Lu K, Jiang X, Wei Q, Zhu L, Wang X, Jin H, Feng L. Ferroptosis inducers enhanced cuproptosis induced by copper ionophores in primary liver cancer. J Exp Clin Cancer Res. 2023 Jun 6;42(1):142. doi: 10.1186/s13046-023-02720-2. PMID: 37277863; PMCID: PMC10242978.













